2019��FDA��ҩ�������棺48����ҩ���� �¶�ҩ���
2020-09-21 δ֪ admin
ԭ��������
���գ�FDA������2019�����ҩ�������棬����������CDER��2019��������ҩ����48��ڽ�20����������2018���59�������ʷ�ڶ�λ��
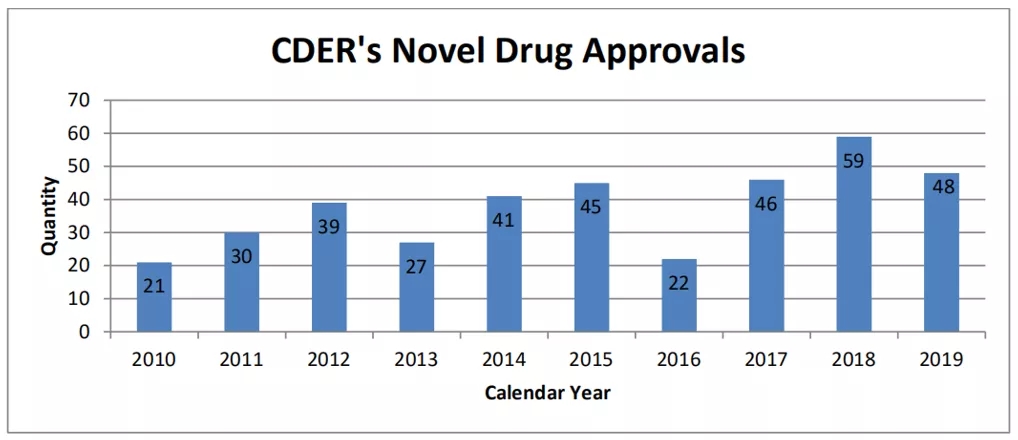
���У��м�������������Ŀ��21�44%����ҩΪ���ƺ������Ŷ�ҩ��20�42%��Ϊfirst-in-class��ҩ��29���ҩ��60%�����ٻ��FDA�Ĵ��ʸ��϶��е�һ�֣�����35%��ÿ���ͨ���ʸ�27%���ͻ�����Ʒ��϶���58%������������ʸ�19%��ü����������棬����һ��ȥ������ݱ������ϸ���ݰɡ�
��������ҩ����������������ҩ
2019�꣬��21��(44%)���ƺ������Ŷ�ҩ���������Ǽ�2018��¶�ҩ�ٶȳ�������ҩ����Ϊ������ҩ��Ŀ���ļ������͡�
CDER����Janet Woodcock��ʿ��������Ҳ��ʾ�������к��������Ļ����������ٻ����û��ҩ�����������ǵIJ��飬��������˵������ν��'�¶�'ҩ�������ζ�Ŷ����������������ϣ������ijЩ����£����������ϣ������
2019��FDA���Ŷ�ҩ
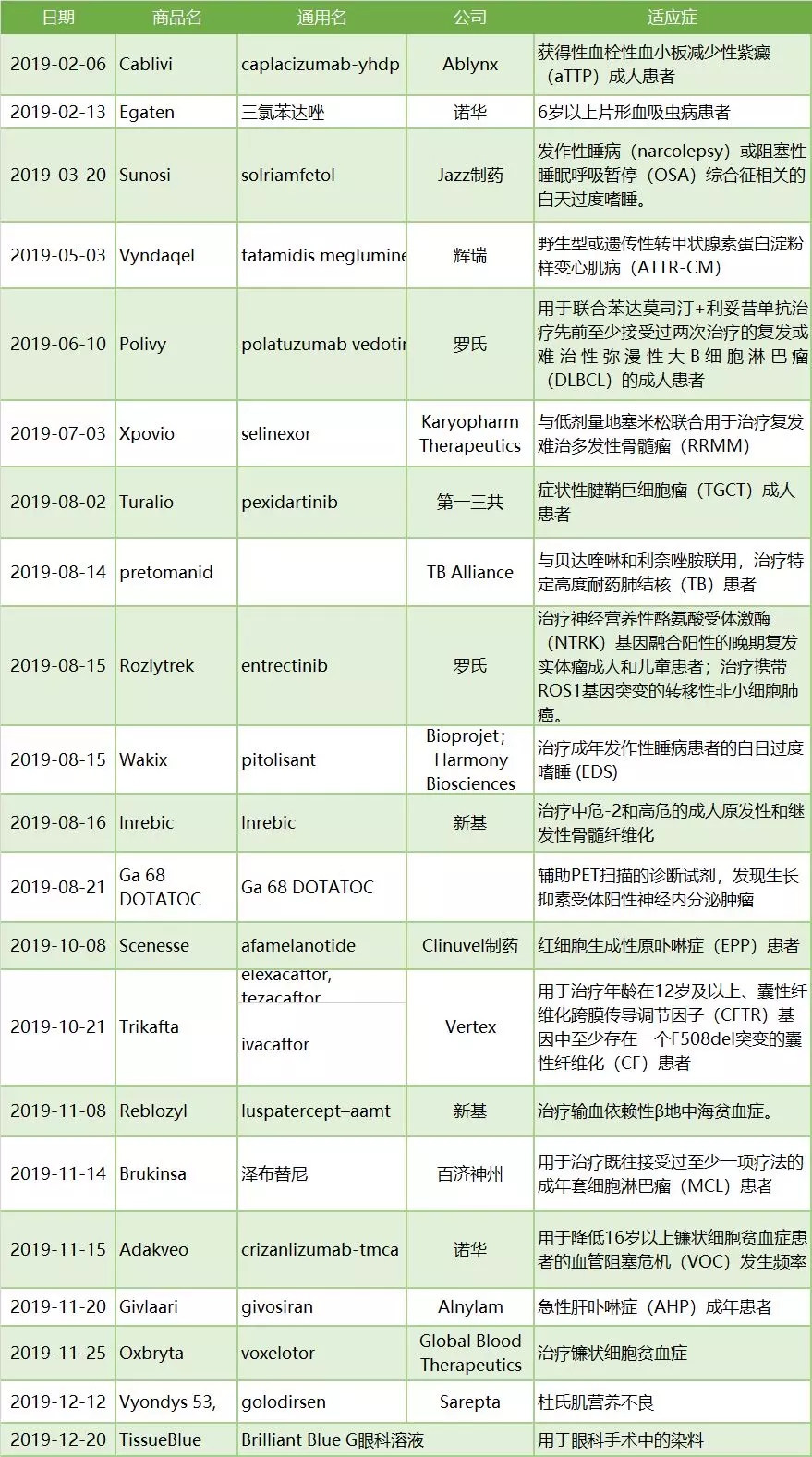
���У�ֵ��ע����ǣ���2�����ҩ��Ļ���ʵ���˸ü���������ҩ��0��1�ķ�Ծ��
Scenesse��afamelanotide����2019��10��8�գ�FDA��Clinuvel��ҩ�з���afamelanotide���У��������ƺ�ϸ��������ԭ߲��֢��EPP�����ߡ���ϸ��������ԭ߲������һ�ֶ��������еĺ����������ݹ��ƣ�ȫ���Լ��5000~10000��EPP���ߡ�Scenesse�ܹ�ͨ���̼��������ڵĺ�ɫ�����ɣ�������������������������ˡ�
Turalio (pexidartinib)��2019��8��2�գ�FDA����һ����������pexidartinib���У���������֢״�����ʾ�ϸ������TGCT�����˻��ߡ���Щ���ߵļ���������ع��������ƣ�������ͨ���������Ƽ���֢״��ֵ��һ����ǣ�pexidartinib������������TGCT��ҩ�Ҳ��FDA������CSF1R���Ƽ���
First-in-Classռ�ȴﵽ42%
��2018����ȣ�2019��FDA������ҩ������Ȼ������11������ҲԶ��2009-2017���ƽ�����֡�������2019��������ҩ�У��״���ҩ��first-in-class��FIC��ռ42%������20�֡�������ҩ�����������Ʒ���ͬ�����û��ƣ��Ҷ�ȫ���߽����нϴ�Ļ���Ӱ�졣
2019�������20��first-in-class��ҩ

热词: