CDE���⽫����˫�����Կ���Blincyto������������
2020-06-01 δ֪ admin
���죬������ҩ�з�������ݿ⣨CPM����ʾ��CDE�⽫����˫�����Կ���Blincyto��blinatumomab/������Ī˫������������������
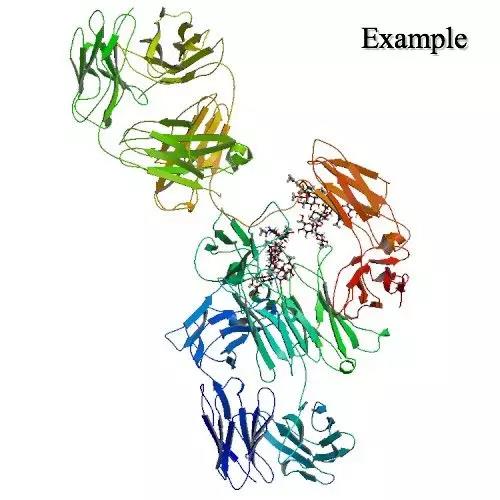
�� blinatumomab�ռ乹��
������Ī˫���ǰ���������˫������Tϸ���Ӻ�����BiTE��ƽ̨������ͬʱ����CD19��CD3��BiTE���ӣ�Ҳ�Ǹù�˾BiTE����ƽ̨����FDA����˫�����Կ��塣����һ�˿�����Bϸ�������CD19��ԭ��ϣ�����һ�˿�����ЧӦTϸ�������CD3�������ϡ���ˣ���ҩ�ܹ���Tϸ��ļ������ϸ���������ٽ����Ƕ�ϸ����ɱ�ˡ�
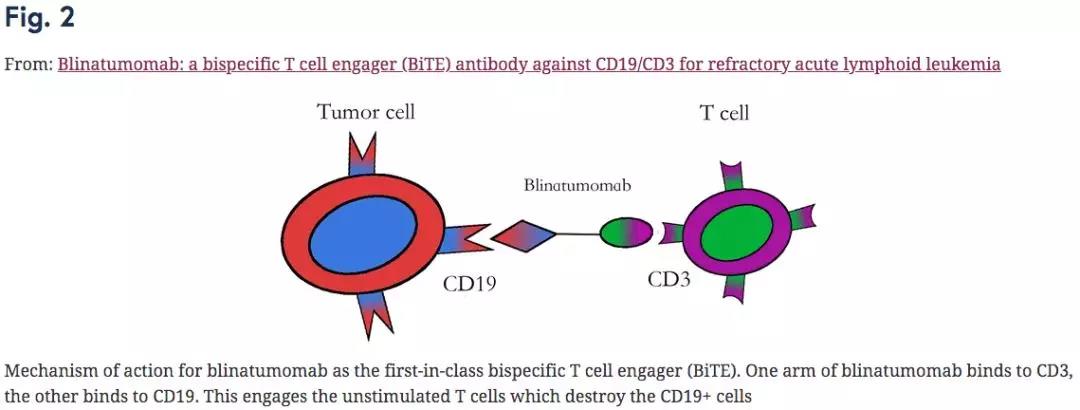
Ŀǰ��Blincyto�Ѿ��������Ƹ���/������Bϸ��ALL���ߣ���FDA������ͨ������Tϸ���������Ѫ��ϸ����ҩ�����ڴ��ȵ�PD-1/L1���塢CAR-Tϸ���Ʒ�����һ���˵�ϸ������Ҳ����Ϊ��ҩ�з�Ͷ�ʵġ��³衱��˫�����Կ����������������������û��ơ���ͬ�ڵ�����˫�����Կ���ӵ�����������Կ�ԭ���λ�㣨��һ����ԭ��������ͬ��λ��������ͬʱ�����ڰ�ϸ������ϸ����һ��ΪTϸ������������ǿ��ϸ���ġ�ɱ��������

������Դ��ҩ����Plus
��ֹĿǰ��ȫ����3��˫�����Կ�����������������Ȼ������е�Removab����2017�����У��ʵ�ǰ�г������۵�˫�����а�����Blincyto�����ϵ�Hemlibra���������鵥��/Emicizumab��������Ϊ��Ѫ����VIII�����
����ҩ���ۺ����ݿ⣨PDB����ʾ��Blincyto��ȫ���г��ϱ������죬2018���Ѵ�2.1����Ԫ�����������ʳ�45%��
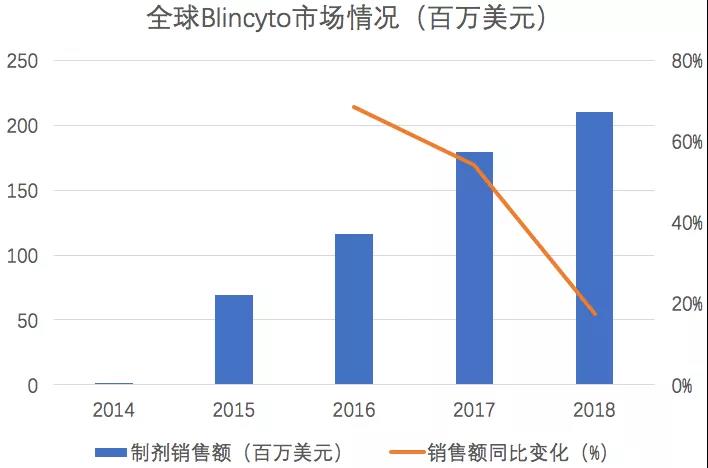
������Դ��PDBҩ���ۺ����ݿ�
��ҩ�з�������ݿ⣨CPM����ʾ��������Ī˫������2019��10��25�ջ�CDE����������Ӧ֢Ϊ������/�����ԣ�R/R��ǰ��Bϸ�������ܰ�ϸ����Ѫ������FDA����Ӧ֢һ�¡�
����6�£���ŷ��ѪҺѧЭ�ᣨEHA����ᰲ�������˱�����Ī˫��������ALL����ʱ�ij�����Ч�����������ʾ������λ�����Ϊ59.8����ʱ�����ܸ�ҩ���ƵĻ�����λ�������ڣ�OS���ﵽ36.5���¡�9�£������ٴ�������ҩ�������״θ����ĸ�ΣBϸ��ALL���ƻ��ߵ�����3�������У�������Ч�������ڻ��ƶ����飬����ע����ǰ��ֹ��
���ҹ���˫�����Կ����������ҩ�з�Ҳ��Ϊ���ȡ��翵�������붫������������������PD-L1/CTLA-4˫�����Կ������ϼױ����������������Ƹ�ϸ����������Ʒ�������ҩҵ������Merus��˾��ɺ�������ú���һ�����EGFR��c-Met˫�е��˫�����Կ������й��Ŀ�������ҵ��Ȩ�棻�쾳���������Ϲ�˾������չ˫�����Կ���TJD5��Tecentriq��������ҩ��
热词: