3��ҩ������������������������̩�����պ���������Ѫ����VIII
2020-05-26 δ֪ admin
���ߣ�����
12��6�գ�CDE������ʾ3��1����ҩ�������������������������ֱ�Ϊ����ҽҩ���ѳ�����ҩ�����������ҡ��ٲ������ϵͳ�Ժ���Ǵ���ҩע����̩�����պ�����ϸ����ע������������Ѫ����VIII��
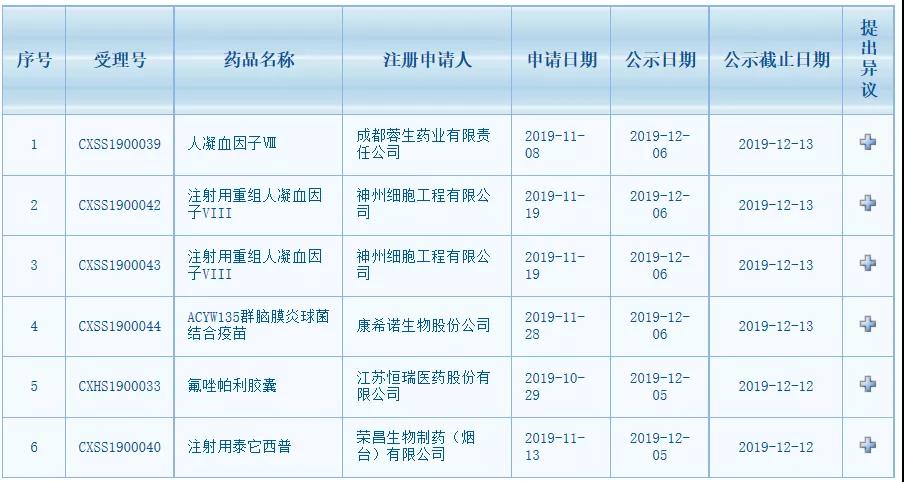
������������
����������һ��PARP���Ƽ�����������ɱ��BRCAͻ�������ϸ��������ҽҩ�ύ�ķ�����������������2019/10/29���CDE�а죬��Ӧ֢Ϊ���Ƽ��������������ϻ��Ƶİ���BRCA1/2�²��Ի������²���ͻ��ĸ������ѳ������ߡ�
�˴�CDE������������Χ��һ��3����������������ƴ���ҩ������������������������������������
��������Ŀǰ������ͬ���Ʒ����������¬���������������������������������������������ۡ�2018�꣬����ҩ��ȫ�����۶�ԼΪ6.72����Ԫ���������۶�ԼΪ3.19����Ԫ��
��������Ƭ��2018��8�����й��������У���Ʒ��Ϊ�����������ٶ�ҽҩ���������������������У��ټ����ݵ�pamiparib������ҩҵ��IMP4297���˸�ҽҩ��HWH-340�Ȳ�Ʒ�����ٴ�����Ρ�
ע����̩������
ϵͳ�Ժ���Ǵ���SLE����ҩ�з��쳣���ѣ��ٴ�����Զδ�õ����㡣��1955��������������FDA�ڹ�ȥ��60����ֻ����һ������SLE��ҩ���У���GSK�ı����ȵ�������ҩ���ڽ���7��20�����й�������
�����ȵ�����һ��BLyS���Ƽ�����̩����������ͬʱ����BLyS��APRIL����ϸ�����ӣ���Ч���B�ܰ�ϸ���ķֻ����죬���ƹ��ȵ����߷�Ӧ���ﵽ�������������������Ŀ�ġ�
�ٲ������ύ��̩����������������11��13�ջ��CDE�а졣�˴�CDE������������Χ��һ��3����������������ƴ���ҩ��̩��������������������������������
ע������������Ѫ����VIII
����Ѫ�Ѳ�ϵ����ȱ����ѪVIII���ӵ�����������Ѫ�����ϰ������߳������ڡ������Ĺؽڳ�Ѫ����֢�����ٺܸߵ��²з��գ�����Σ��������2018�꣬ȫ��Ѫ�Ѳ���������Լ Ϊ77.4���й���Լ��14.0���������д�Լ85%Ϊ����Ѫ�Ѳ����ߡ�
������ѪVIII���ӵ������ȶ��Բ�����ͣ�������ѪVIII���ӵ����������ռ����ż��ߡ������Ѷȴ�Ŀǰ���й���δ�о������еĹ���������ѪVII���ӵ���ҩ����ڸò�Ʒ�����ٴ��εĹ�����ҵ���������硢�ɶ���������ҩҵ��
����ϸ���ύ��ע������������Ѫ����VIII����������11��19�ջ��CDE�а�.�˴�CDE������������Χ������4���������������������������
*��������������פ����ҽҩ��������д���۵���������߱��ˣ�����������ҽҩ����������

热词: