����Ȼ����־���״ν�ʾ�鵰����������������(Kla)���ػ���
2020-02-28 δ֪ admin
�����¼�
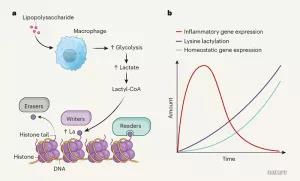
���졶��Ȼ����־������֥�Ӹ��ѧ��Ӣ������С���һƪ�����Ŵ������������£��״ν�ʾ���鵰����������������(Kla)������ػ��ƣ���֤�����ڻ����������иı����ϸ���е����á�����������һϵ�л�ѧ�������ķ�����ȷ�ϴ��������鵰���еĴ��ڡ�13C���ʵ��������������������ᣬ���������������ǽ��⡣һϵ�е�ʵ��֤��ϸ����Դ�������Ũ�ȣ����Ե��ظ��鵰�����ε�ˮƽ�������Ծ���ϸ����Ϊģ�ͳ���̽�����鵰��Kla��ϸ�����ܵ�Ӱ�죬���־���ϸ��������л�����仯������Ũ�ȵ���ߣ����������鵰��Klaˮƽ�ͻ������ı仯���������ﻯѧʵ����ʾKla��������������ø��P300����ø���Դ��鵰��Kla��Ӧ������˼���ǣ��ڶ�������ģ��ʵ���У����߷����鵰��Kla��ˮƽ��������֯�ڵľ���ϸ������Ũ�Ⱥ�ȱ����أ�������˵��ڴ�inflammatory M1 ����ת���anti inflammatory M2 ���͡�����������������������������ø��LDHS. ��Щ�������������Ŵ�ѧͨ���ڵ�������ϸ�����ܷ�������Ҫ���á�
ҩԴ����
�鵰�ײ�ͬλ��Ļ�ѧ�����DZ����Ŵ����ص���Ҫ���ƣ������������������ữ�Ǵ����֪���鵰�����λ��ơ�����ǰ�鵰����������δ֪����Ȼ�����Ǹ���Ũ�ȴ�л�����Ϊϸ����л����ᵼ���鵰����������������Kac�������������Ʋ�ϸ����Ũ�Ⱥܸߵ�����Ҳ���ܵ����鵰�������������������������������ҵ������鵰�����Ķ����ƺ�ȷʵ��Kla������������72����Ϊ��֤ʵ������֣�����ѧ�ϳ������������鵰���Ķ��գ����HPLC����ʱ�䡢MS/MSͼ���뽵�����һ�¡�ʶ��Kla����Ҳ֤����ϸ�����鵰��������ȷʵ���Ա������������������ˡ�С��ϸ���й�����28��Klaλ�㡣
ͨ��������������ϳɵ�ø���Ժ�ͬλ�ر�����߷����鵰��Klaˮƽ������Ũ������أ����ƺ���ϸ������Ӧ���ǽͽ��������仯��һ�����ơ����֪��ȱ���ı�ϸ����лģʽ���յ��ǽͽ⣬���߷���ȱ��Ҳ����Klaˮƽ������Kac��Ӱ�졣������ϸ��M1�ȿ���M2�������������ǽͽ⣬���߷�����LPS����M1����ϸ�����ǽͽ������Ũ�����ӡ��鵰��Klaˮƽ��֮���ӣ�����Kla�����Kac�ϵ�����RNA������M1�������������Ѹ�����ӵ��ܿ쿪ʼ�ָ���������ά����֯��̬ƽ�⼰M2 �������˿����ϵĻ���1223��������ȴ�Ȳ����ӡ������鵰��Klaˮƽ�߶���ء�M0����ϸ���������������Ծ����������ơ����߰�������ƽ��������ʱ��������ϸ���ӵ�����������������Ӧ���ͬʱ�Ѿ���ʼ����Klaͨ·Ϊ��ʰ�о�������ͨ���ı����ṩ������֤������Ũ�ȸı����ȡ�Kla�仯�ǽ�����������֤��Kla�仯�ǻ������ı�����������ݱ����ոջ��ŵ��������HIFaҲ���ܽ鵼����仯�������ڷ�ϸ��������ͨ��ø��Ӧ���������鵰�ף�����ȷʵ�����յ����ƻ���ת¼��
�����Ŵ����ײ�����ػ���������ֱ��Ӱ��ϸ�����ܡ�Kla�Ǹ�ȫ�µ��ػ��ƣ��������ֻ�����˾���ϸ����������ϸ�������û��д���һ���о���������ΪŨ�Ⱥܸ�������ϸ��״̬��һ�����Ա������Ҳ�����Ƕ���������̰���ϸ��������ָ�ꡣһ�������֪�������������е�WarburgЧӦ����������֯��ʹ����������ʱҲʹ��Ч�ʸ��͵��ǽͽ���Ϊ������Դ��һ��������Ϊ��������ʱ���������������Ϲ������ؼ������ǽͽ���Ը���Ч�ѹ�����ϳɵ�ԭ���ϡ����������֯���Ậ��������������֯��������������ϸ�����ܻ�����������������ź�������ε������������ɡ�ȥ�����Ķ�Kla��ǵĵ�����˿��ܳ�Ϊ�µĿ����е㣬�ƺ���Kla��ˮ������ˮ��Kac����Ѿ��ж��ҩ�����С�
热词: